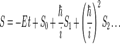Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Періодичний закон Менделєєва
Періодичний закон хімічних елементів і його графічне відображення – періодична таблиця – є сучасною основою для вивчення властивостей елементів та їх сполук. Перше формулювання закону було таким: властивості елементів та їх сполук перебувають у періодичній залежності від величини атомної ваги елементів (Д.Менделєєв, 1869 р.). З часом формулювання закону змінювалось і в сучасному викладенні читається так: властивості хімічних елементів та їх сполук перебувають у періодичній залежності від величини заряду ядер їх атомів Періодичний закон Мендєлєєва: хім. вл. електронів періодично повторюються. Закон знайшов відображення в періодичній системі елементів, в основу побудови якої була покладена атомна маса. Але тільки квантова теорія дала пояснення періодичному закону. Періодичні зміни властивостей хімічних елементів обумовлені правильним повторенням електронної конфігурації зовнішнього енергетичного рівня (валентних електронів) їх атомів із збільшенням заряду ядра. Графічним зображенням періодичного закону є періодична таблиця. Вона містить 7 періодів і 8 груп. Період -- горизонтальні ряди елементів з однаковим максимальним значенням головного квантового числа валентних електронів. Номер періоду позначає число енергетичних рівнів в атомі елементу. Періоди можуть складатися з 2 (перший), 8 (друге і третє), 18 (четвертий і п'ятий) або 32 (шостий) елементів, в залежно від кількості електронів на зовнішньому енергетичному рівні. Останній, сьомий період незавершений. Всі періоди (крім першого) починаються лужним металом (s-елементом), а закінчуються благородним газом (ns2 np6). Атом гелію. Гелій - другий елемент періодичної системи хімічних елементів Д. І. Менделєєва з атомним номером 2. Розташований в головній підгрупі восьмий групи, першому періоді періодичної системи. Очолює групу інертних газів в періодичній системі. Позначається символом He. Проста речовина гелій - це інертний одноатомний газ без кольору, смаку і запаху. Гелій - один з найбільш поширених елементів у Всесвіті, він посідає друге місце після водню. Також гелій є другим за легкістю (після водню) хімічною речовиною. Гелій здобувається з природного газу процесом низькотемпературного розділення - так званої фракційної перегонкою. Гелій - найменш хімічно активний елемент. Багато з'єднання гелію існують тільки в газовій фазі у вигляді так званих ексимерних молекул, у яких стійкі порушені електронні стану і нестійкий основний стан. Гелій утворює двоатомні молекули He2 +, фторид HeF, хлорид HeCl (ексимерні молекули утворюються при дії електричного розряду або ультрафіолетового випромінювання на суміш гелію з фтором або хлором). Природний гелій складається з двох стабільних ізотопів: 4He (ізотопна поширеність - 99,99986%) і набагато більш рідкісного 3He (0,00014%; зміст гелію-3 в різних природних джерелах може змінюватись у досить широких межах). Відомі ще шість штучних радіоактивних ізотопів гелію.
2 5. Молекула водню. Моле́кула во́дню — найпростіша хімічна молекула, що складається з двох атомів водню. До її складу входять два ядра хімічного елементу водню й два електрони. Внаслідок взаємодії між електронами утворюється ковалентний хімічний зв'язок. Окрім основної ізотопічної модифікації H2, існують різновиди, в яких один або обидва протії замінені іншими ізотопами водню — дейтерієм і тритієм: HD, HT, D2, DT, T2. Симетричність чи несиметрічність молекули відіграє роль при її обертанні. А́том во́дню — найпростіший із атомів хімічних елементів.Він складається з позитивно зарядженого ядра, яке для основного ізотопа є просто протоном, і одного електрона. Квантовомеханічна задача про дозволені енергетичні стани атома водню розв'язується точно. Зважаючи на цю обставину, хвильові функції, отримані як власні функції цієї задачі, є базовими для розгляду решти елементів періодичної таблиці. Саме тому атом водню має велике значення для фізики й хімії. Для водню відомо теж три ізотопи: 1H (ядро складається лише з одного протона), 2H (ядро складається з одного протона і одного нейтрона), 3H (ядро складається з одного протона і двох нейтронів). Деякі ж хімічні елементи складаються з досить великої кількості ізотопів. Природа хімічного зв’язку. Лише деякі хімічні елементи (благородні гази) за звичайних умов знаходяться в стані одноатомного газу. Атоми інших елементів, навпаки, в індивідуальному вигляді не існують, а входять до складу молекул або кристалічних ґраток, утворених сукупністю атомів. Отже, існує причина, за якою атоми зв’язуються один з одним. Цією причиною є хімічний зв’язок, який зумовлений тим, що між атомами діють певні електростатичні сили, здатні утримувати атоми один біля одного. Доведено, що в утворенні хімічного зв’язку між атомами головна роль належить валентним електронам (електронам зовнішнього рівня, які найслабше зв’язані з ядром). Згідно з теорією хімічного зв’язку найбільшу міцність мають зовнішні оболонки, які складаються з двох або восьми електронів. Благородні гази мають саме такі електронні оболонки. Це і є причиною того, що благородні гази за звичайних умов не вступають у хімічні реакції з іншими елементами. Атоми, які мають на зовнішньому рівні менше восьми (або двох) електронів, намагаються набути структури благородних газів. Тому при утворенні молекули в ході хімічної реакції атоми намагаються набути стійку восьмиелектронну або двохелектронну оболонку. Таким чином хімічні зв’язки утворюються завдяки зсуву або перенесенню електронів від одного атома до іншого.
Стаціонарна теорія збурень. Тео́рія збу́рень — метод розв'язку математичних задач, що базується на відомому розв'язку й розглядає відхилення від цього розв'язку пропорційними певному малому параметру. Метод збурень є одним із основних методів знаходження розв'язків квантово-механічних рівнянь руху, зокрема рівняння Шредінгера. Розрізняють метод збурень для стаціонарного рівняння Шредінгера й метод збурень для часового рівняння Шредінгера в тому випадку, коли збурення залежить від часу. Стаціонарне рівняння Шредінгера — рівняння, яким визначається хвильова функція квантової системи в стані, який не змінюється з часом. 28,.Метод квазікласичного наближення. Квазікласичне наближення - метод розв'язування квантовомеханічних задач, що використовує малість сталої Планка, а тому застосовний для квантовомеханічних систем, поведінка яких близька до поведінки відповідних систем класичної фізики. Квазікласичне наближення часто називають також наближенням ВКБ (Вентцеля-Крамерса-Брілюена). У квантовій механіці визначальну роль відіграє стала Планка. При
Хвильову функцію можна задати у вигляді
де A - стала, а де m - маса квантовомеханічної частинки, U - потенціал, в якому вона рухається. Це рівняння лише останнім членом відрізняється від класичного рівняння Гамільтона-Якобі. Якщо в ньому покласти Метод квазістатичних наближень пропонує провести розклад S в ряд Тейлора:
|
|||||||
|
Последнее изменение этой страницы: 2016-06-26; просмотров: 462; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.233.26 (0.008 с.) |
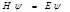 , де
, де 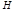 -гамільтоніан,
-гамільтоніан, 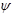 -хвильова функція, яку треба визначити,
-хвильова функція, яку треба визначити,  -це певне дійсне число, яке треба визначити — енергія стаціонарного стану. Стаціонарне рівняння Шредінгера є рівнянням Штурма-Ліувіля, із якого потрібно визначити хвильові функції можливих квантових станів і можливі значення енергії
-це певне дійсне число, яке треба визначити — енергія стаціонарного стану. Стаціонарне рівняння Шредінгера є рівнянням Штурма-Ліувіля, із якого потрібно визначити хвильові функції можливих квантових станів і можливі значення енергії  . Знайдені із стаціонарного рівняння Шредінгера хвильові функції зазвичай індексуються квантовими числами.Визначений спектр енергії може бути дискретним чи неперервним. Стаціонарне рівняння Шредінгера займає центральне місце в квантовій механіці. Воно розв'язується аналітично лише для невеликого числа систем, серед яких більшість модельних. Розвинуто багато методів наближеного розв'язання стаціонарного рівняння Шредінгера, серед яких квазікласичне наближення, теорія збурень, варіаційний метод а також чисельні методи.
. Знайдені із стаціонарного рівняння Шредінгера хвильові функції зазвичай індексуються квантовими числами.Визначений спектр енергії може бути дискретним чи неперервним. Стаціонарне рівняння Шредінгера займає центральне місце в квантовій механіці. Воно розв'язується аналітично лише для невеликого числа систем, серед яких більшість модельних. Розвинуто багато методів наближеного розв'язання стаціонарного рівняння Шредінгера, серед яких квазікласичне наближення, теорія збурень, варіаційний метод а також чисельні методи.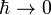 квантові ефекти зникають і фізичні системи описуються рівняннями класичної фізики. Стала Планка - мала величина, й у багатьох випадках поведінка квантовомеханічної системи близька до поведінки відповідної класичної системи. Квазістатичне наближення - це метод розкладу хвильової функції за степенями
квантові ефекти зникають і фізичні системи описуються рівняннями класичної фізики. Стала Планка - мала величина, й у багатьох випадках поведінка квантовомеханічної системи близька до поведінки відповідної класичної системи. Квазістатичне наближення - це метод розкладу хвильової функції за степенями  , який дозволяє значно спростити розв'язування квантовомеханічних задач, водночас зберігаючи їхню квантову природу.
, який дозволяє значно спростити розв'язування квантовомеханічних задач, водночас зберігаючи їхню квантову природу. ,
, - певна функція, що задовільняє рівнянню
- певна функція, що задовільняє рівнянню 
 , то рух частинки стане повністю класичним.
, то рух частинки стане повністю класичним.